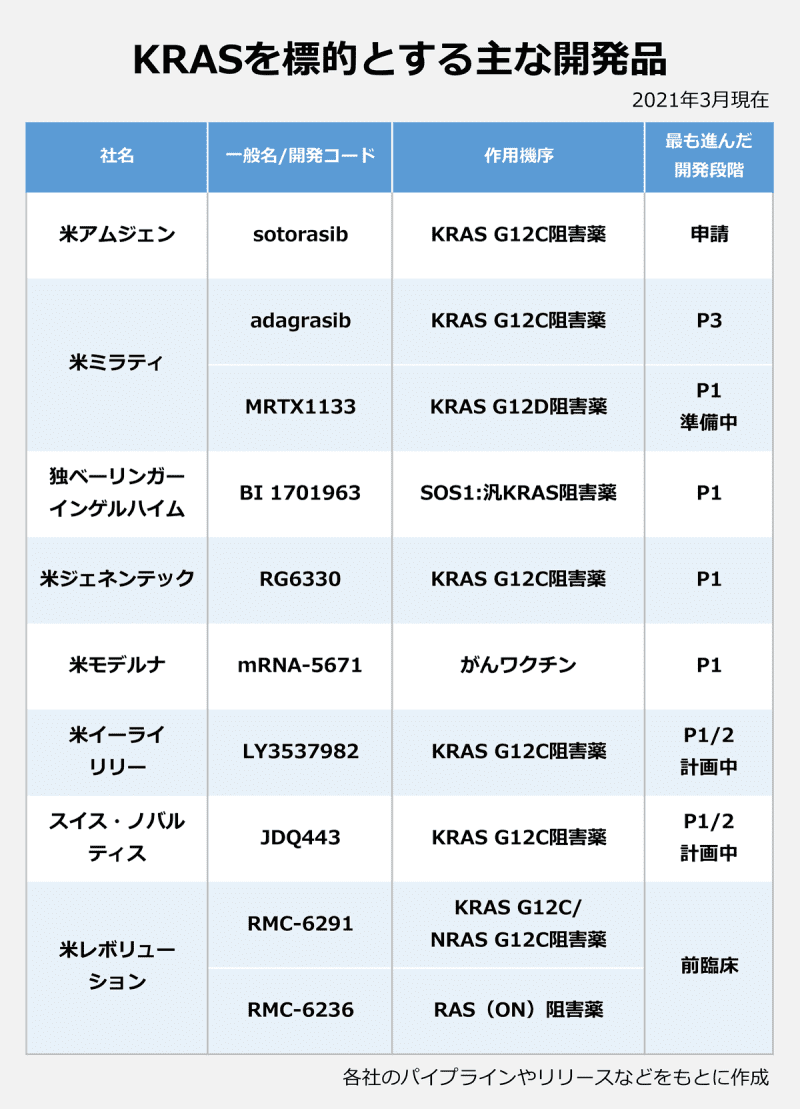
[vc_row][vc_column][vc_row_inner][vc_column_inner][vc_column_text]ミラティ社(Mirati Therapeutics)が5月26日、経口KRAS阻害剤アダグラシブ(adagrasib)の第2相KRYSTAL-1試験の非小細胞肺がんコホートの結果を発表しました。43%のORRを示しているデータを発表したものの、安全性に関しての懸念からか、発表後同社の株価は20%以上下落しました。
今回の発表では、アダグラシブのKRYSTAL-1試験の非小細胞肺がんコホートの最新の臨床試験結果を発表したもので、ORRでは43%と良好なデータを示したものの、試験参加者の43%に肝酵素値の上昇などグレード3-4の治療関連有害事象(TRAE)が認められました。
同社は来週のASCO(米国臨床腫瘍学会)の年次総会で、脳転移を起こした非小細胞肺がんに対する同薬の有効性に関する追加データを含め、試験の詳細な結果を発表する予定です。
治験担当医師のAlexander Spira氏は、このデータセットが「治療済みで安定したCNS(中枢神経系)転移を有する患者を含む、分子および臨床サブグループ全体でアダグラシブの臨床活性が肯定的である」ことも示していると発表している。
経口KRAS阻害剤への期待
アダグラシブは、様々な癌に共通して存在し、増殖因子として働くG12Cと呼ばれるKRASタンパク質の変異型に結合する阻害剤として作用します。KRASタンパク質の変異は非小細胞肺がんの約4分の1に見られます。特にKRAS G12C変異は症例の約13%に見られるものの、アムジェンのKRAS阻害剤ルマクラス(ソトラシブ)が初めて承認されるまで、長期間にわたり効果的な治療手段がありませんでした。
アムジェンのルマクラスはアナリストコンセンサスの売り上げ予測では10億ドル以上の高い売上が期待されています。
今年初めにJDQ443候補でフェーズ1bの結果を報告したノバルティス、米メルク、ベーリンガーインゲルハイムなど、KRAS阻害剤におけるライバルのリストは増加傾向にあります。
出典:アンサーズニュース KRAS阻害薬 今夏にも実用化へ…米アムジェン、非小細胞肺がんでsotorasibを米欧申請
期待通りの試験結果も安全性に関して異なる市場からの反応
今回の第1/2相KRYSTAL-1試験では、KRAS G12C変異を有する進行性固形腫瘍患者を対象に、アダグラシブの単独投与および他剤との併用投与を評価しています。
昨年10月15日のカットオフ時点で、第2相非小細胞肺がんコホートにおいて112名の患者が奏功の評価可能な状態にありました。
同社によると、43%のORRに加え、病勢コントロール率は80%、奏効期間(DOR)中央値は8.5カ月、無増悪生存期間(PFS)中央値は6.5カ月であったという。1月15日のデータカットオフ時点では、患者の全生存期間は中央値で12.6カ月でした。
これは、中間段階試験でルマクラス(ソトラシブ)で治療された同様の患者集団で記録された37%のアムジェン社よりもわずかですが高いトップライン結果であり、アダグラシブが少なくとも同等の有効性を提供できることを示唆している。
頭蓋内腫瘍の退縮
また、前治療で中枢神経系転移を有する患者33名を対象に、探索的かつレトロスペクティブなサブグループ解析を実施した。
同社は、「これらの結果は、修正RANO-BM基準に基づく頭蓋内ORRが33%、頭蓋内病勢コントロール率が85%であるなど、CNSに特異的な活性を示すものであった」と述べている。
安全性プロファイルはこれまでと一致と発表も。。。
薬剤の安全性プロファイルは、これまでの報告と「一致」しており、新たな安全性シグナルは認められなかったと述べていますが、データによると、試験参加者の43%に肝酵素値の上昇や貧血を含むグレード3-4の治療関連有害事象(TRAE)が認められました。
また、治療に関連する死亡例が2件報告され、7%の参加者が治療を中断しました。
しかし、トップラインの結果には、アダグラシブで治療された患者の43%が肝酵素のレベル上昇や貧血などの重篤な治療関連の副作用を経験したことを示す安全性データが伴いました。
一部の投資家は安全性のデータに関して驚いたようで、同社がデータを発表した後、ミラティの株式は20%以上下落しました。
キイトルーダとの併用投与の試験結果
昨年11月、Mirati社は、アダグラシブとメルク社のキイトルーダ(ペムブロリズマブ)併用投与を評価するKRYSTAL-1の第Ib相コホートからの予備調査結果を発表しています。
その分析では、評価可能な7人の被験者に対する非小細胞肺がんのファーストラインのデータでは、4人が部分奏効を確認し、7人全員が37%から92%の腫瘍退縮を示しています。
FDAの決定は今年末。ルマクラスと競合へ
FDAは現在、KRASG12C変異を有する非小細胞肺がんで、少なくとも1回の全身療法を受けたことのある患者さんに対する治療薬としてアダグラシブを審査しています。
この申請に関しては、12月中旬までに決定される予定です。承認されれば、アムジェンのKRAS阻害剤ルマクラス(ソトラシブ)と競合することになります。
ルマクラスは、米国と欧州でKRAS変異肺がんを対象に既に承認されています。
アムジェンは最近、第1/2相CodeBreaK 100試験で前治療歴の多い非小細胞肺がん患者を対象とした2年間の解析で、ORR40.7%、DOR中央値12.3カ月を示したと報告しました。また、PFS中央値は6.3カ月、全生存期間は12.5カ月で、2年時点で32.5%の患者が生存していることが示されました。
一方、ミラティ社は、転移性非小細胞肺がんの治療歴のある患者を対象とした第3相KRYSTAL-12試験の確認試験において、アダグラシブとドセタキセルを比較することも行っています。
さらに、アダグラシブは、大腸がんや膵臓がんなど、他のKRASG12C変異の固形がんにおいても、単剤および併用で評価されています。
参照文献
Investigational Adagrasib Delivers Positive Results in Registration-Enabling Study of Patients with KRASG12C-Mutated Advanced Non-Small Cell Lung Cancer[/vc_column_text][vc_column_text]
あわせて読みたい
[/vc_column_text][/vc_column_inner][/vc_row_inner][/vc_column][/vc_row]

