【2024.04.17配信】小林製薬の「紅麹」を含む健康食品の健康被害問題で、機能性表示食品制度の在り方についても議論になっている。健康食品関連のコンサルティングを行う企業がこのほど調査レポートをリリースし、見本となったとされる米国のダイエタリーサプリメント制度ではGMP(Good Manufacturing Practice:適正製造規範)が義務であるなどの制度の違いを解説した。
健康食品業界に特化したコンサルティング会社である株式会社グローバルニュートリショングループ(本社:東京都豊島区西池袋5-17-11、代表取締役:武田 猛氏)が、「機能性表示食品制度と米国ダイエタリーサプリメント制度の比較」と題した調査レポートを公表した。
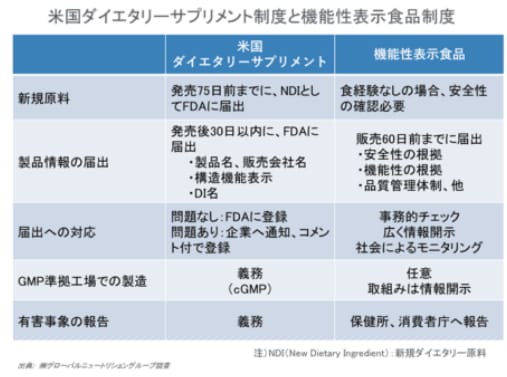
GMPに関しては米国の制度が厳格であるとしている。米国ダイエタリーサプリメントは、GMP準拠が義務付けられているのに対して、機能性表示食品制度では「サプリメント形状の加工食品については、GMPに基づく製造工程管理が強く望まれる」とガイドラインに示されている。
大きな違いとして、米国は国(FDA)がGMP規範を作り、監査(査察)を行っているが、日本は国が指針を示すにとどまり、規範は業界団体等民間に任せていて、その監査も民間が実施しているとした。そしてもう1点、原材料の100%同一性確認試験を義務付けている点が、米国GMPが厳格と言われる理由でもあるとしている。
「有害事象の報告」でも米国ダイエタリーサプリメント制度では義務化されており、先行しているとしている。
「ダイエタリーサプリメントおよび非処方箋薬に対する消費者保護法(Dietary Supplement and Nonprescription Drug Consumer Protection Act)」では、有害事象(Adverse Event)をダイエタリーサプリメントの使用によって生じる健康に係る事象で有害(不都合)なもの、と定義。その上で、事業者は、入手した重篤な有害事象に関する報告を15営業日以内にFDA長官に届けなければならない、とされているという。ただし、「保護されるべき情報」として、重篤な有害事象に関する報告、更新情報、及びそれ以外で、FDA長官に自発的に提出された有害事象報告は、有害事象について公表された安全性情報が、当該製品と有害事象との因果関係を認めるものではないこと、と示されているという。また、「解釈のルール」として、総ての有害事象報告はその提出をもって、当該ダイエタリーサプリメントが当該有害事象の原因になっていると認めるような解釈はしてはならないとされており、事業者が有害事象の届出を躊躇することがないように配慮もされていると解説している。
これに対し、機能性表示食品制度では、健康被害情報の収集・報告について「健康被害の発生及び拡大のおそれがある場合は、消費者庁食品表示課へ速やかに報告する。」「健康被害情報に係る都道府県等(保健所)に対する報告については、食品衛生法等の関係規定に従い適切に行う。」とガイドラインに示されているという。
一方、機能性表示食品制度は「透明性が高い」とも指摘。
機能性表示食品制度は、安全性の根拠、機能性の根拠、品質管理体制等を消費者庁に販売前に届出をし、その内容が消費者庁のHP上で公表される。一方、ダイエタリーサプリメント制度では、機能性表示の内容と成分を販売後30日以内にFDAに届出をする制度で、機能性の根拠は届出する必要はないとした。
「機能性表示食品制度は米国の制度と比べて透明性が高いことから、その分、疑義が出やすく、届出撤回の件数も多数に上ると考察される」と分析している。
■株式会社グローバルニュートリショングループHPのリリース
https://global-nutrition.co.jp/information/2024-04-15/