
2021年6月17日
アッヴィ合同会社
第III相維持療法試験の結果において、リサンキズマブを投与したクローン病患者さんが1年時の内視鏡的改善および臨床的寛解を達成
●リサンキズマブの静脈内投与による寛解導入治療により臨床的改善がみられたクローン病患者さんを対象とした本試験において、リサンキズマブ360mg皮下投与群が、リサンキズマブ投与中止群(対照群)よりも、1年(52週)時の内視鏡的改善および臨床的寛解を達成した割合が有意に高い結果1
●本試験の全体的な安全性に関する結果は、これまでに確認されているリサンキズマブの安全性プロファイルとおおむね一致しており、新たな安全性のリスクは認められず1-7
●インターロイキン-23(IL-23)阻害薬のリサンキズマブは、成人の中等症から重症のクローン病、その他複数の免疫関連疾患の治療薬として開発中1,8-10
イリノイ州ノースシカゴ、2021年6月2日(米国時間)-アッヴィ(NYSE: ABBV)は本日、中等症から重症のクローン病を有する成人患者さんを対象とした第III相維持療法試験(FORTIFY試験)から得られた良好なトップライン結果を発表し、リサンキズマブ 360 mg投与群(8週間ごとの皮下投与)において主要評価項目である1年時の内視鏡的改善および臨床的寛解を達成したことを報告しました1。
本試験では、先に実施したリサンキズマブの静脈内投与(IV)による12週間の寛解導入治療で効果がみられた患者さんを対象とし、リサンキズマブ180 mg投与群、リサンキズマブ360 mg投与群またはリサンキズマブ投与中止群(リサンキズマブIVによる寛解導入治療のみの対照群)に、再度無作為に割り付けました1。また、各地域の規制要件により、米国内と米国外の解析計画にはそれぞれ異なる主要評価項目および副次評価項目を採用しました1。主要評価項目は、52週時の内視鏡的改善および臨床的寛解としました1。臨床的寛解は、米国内の解析計画ではクローン病活動指数(CDAI)により定義し、米国外の解析計画では排便回数と腹痛(SF/AP)により定義しました1。
1年時に内視鏡的改善を達成した患者さんの割合は、リサンキズマブ360 mg投与群では47%であったのに対し、寛解導入治療のみの対照群では22%でした(p<0.001)1。臨床的寛解(CDAI、米国内の解析計画に基づく)を達成した患者さんの割合は、寛解導入治療のみの対照群では41%であったのに対し、リサンキズマブ360 mg投与群では52%と有意に高い結果でした(p<0.01)1。また、臨床的寛解(SF/AP、米国外の解析計画に基づく)を達成した患者さんの割合は、リサンキズマブ360 mg投与群では52%であったのに対し、寛解導入治療のみの対照群では40%でした(p=0.004)1。さらに、内視鏡的寛解を達成した患者さんの割合は、リサンキズマブ360 mg投与群では39%であったのに対し、寛解導入治療のみの対照群では13%でした(名目上のp値<0.001)1。加えて、完全寛解を達成した患者さんの割合は、リサンキズマブ360 mg投与群では29%であったのに対し、寛解導入治療のみの対照群では10%でした(名目上のp値<0.001)1。完全寛解とは、同じ患者さんを対象とし、臨床的寛解(CDAI)かつ内視鏡的寛解によって定義される厳密な評価項目です1。
アッヴィのバイスチェアマン兼プレジデントであるマイケル・セヴェリーノ医学博士(M.D.)は次のように述べています。「これまでの当社のグローバル臨床試験プログラムにおいて、リサンキズマブは中等症から重症のクローン病を有する患者さんを対象に、臨床的に意義のある内視鏡的改善率および臨床的寛解率を示しています。これらの結果は、現在の治療法では十分な疾患コントロールが難しい患者さんを多く含む中等症から重症のクローン病を有する患者さんのために、リサンキズマブの開発を進めていく上で新たな一歩を示すものです。」
リサンキズマブ180 mg投与群(8週間ごとの皮下投与)については、米国内の解析計画では主要評価項目を達成しましたが、米国外の解析計画では達成しませんでした1。本試験で内視鏡的改善を達成した患者さんの割合は、リサンキズマブ180 mg投与群では47%であったのに対して、寛解導入治療のみの対照群では22%でした(米国内の解析計画ではp<0.001、米国外の解析計画では名目上のp値<0.001)1。また、臨床的寛解(CDAI、米国内の解析計画に基づく)を達成した患者さんの割合は、リサンキズマブ180 mg投与群では55%であったのに対して、寛解導入治療のみの対照群では41%でした(p<0.01)1。さらに、臨床的寛解(SF/AP、米国外の解析計画に基づく)を達成した患者さんの割合は、リサンキズマブ180 mg投与群では46%であったのに対して、寛解導入治療のみの対照群では40%でした(名目上のp値=0.124)1。1年時に内視鏡的寛解を達成した患者さんの割合は、リサンキズマブ180 mg投与群では30%であったのに対して、寛解導入治療のみの対照群では13%でした(名目上のp値<0.001)1。なお、完全寛解を達成した患者さんの割合は、リサンキズマブ180 mg投与群では25%であったのに対して、寛解導入治療のみの対照群では10%でした(名目上のp値<0.001)1。
ベルギー、ルーベン大学病院消化器・肝臓内科のマーク・フェランテ医学博士(M.D.、Ph.D.)は次のように述べています。「リサンキズマブによる維持療法を1年行うと、患者さんのほぼ半数が内視鏡的改善を達成することができました。進行性の慢性疾患であるクローン病では、内視鏡的改善を達成することが困難な患者さんが多く、本試験で得られた達成率はクローン病患者さんに希望を与えるものとなります」
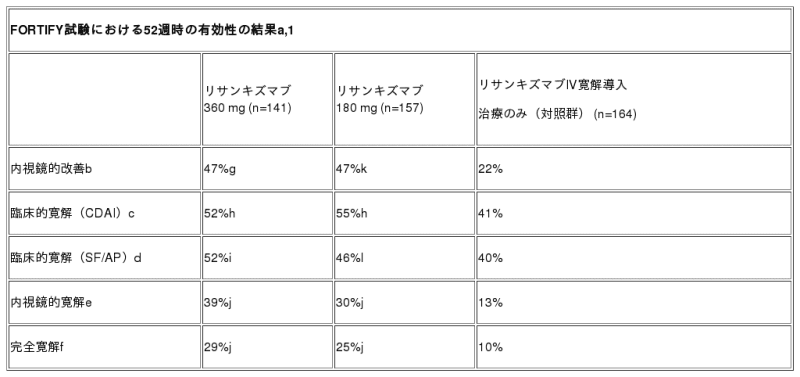
a 主要評価項目は、52週時の内視鏡的改善(米国内外の解析計画とも共通)および臨床的寛解(米国内の解析計画ではCDAI、米国外の解析計画ではSF/APに基づく)。
b 内視鏡的改善は、中央審査委員の判定による簡易版クローン病内視鏡スコア(SES-CD)がベースラインに比べ50%超(病変が回腸に限局しており、ベースラインのSES-CDが4の患者さんではベースラインに比べ50%以上)減少した場合と定義。
c 臨床的寛解(CDAI)は、CDAIスコアが150未満の場合と定義。これは、米国内の解析計画では主要評価項目であり、米国外の解析計画では副次評価項目。
d 臨床的寛解(SF/AP)は、1日の平均排便回数と1日の平均腹痛スコアに基づき評価。これは、米国外の解析計画では主要評価項目であり、米国内の解析計画では副次評価項目。
e 内視鏡的寛解は、中央審査委員の判定によるSES-CDが4以下かつベースラインに比べ2点以上減少しており、個々のサブスコアに1を超えるものがない場合と定義。米国内外ともに副次評価項目。
f 完全寛解とは、同じ患者さんを対象とし、臨床的寛解(CDAI)かつ内視鏡的寛解によって定義される評価項目。米国内外ともに副次評価項目。
g リサンキズマブによる寛解導入治療のみの対照群と比較してp<0.001。米国内外の解析計画ともに統計学的に有意。
h リサンキズマブによる寛解導入治療のみの対照群と比較してp<0.01。米国内の解析計画では統計学的に有意。米国外の解析計画では名目上のp値。
i リサンキズマブによる寛解導入治療のみの対照群と比較してp<0.01。米国内外の解析計画ともに統計学的に有意。
j リサンキズマブによる寛解導入治療のみの対照群と比較してp<0.001。米国内外の解析計画ともに名目上のp値。
k リサンキズマブによる寛解導入治療のみの対照群と比較してp<0.001。米国内の解析計画では統計学的に有意。米国外の解析計画では名目上のp値。
l 統計学的有意性なし。
FORTIFY試験は52週間の維持療法を行うピボタル試験であり、本試験期間中に確認されたリサンキズマブの安全性プロファイルは、両用量ともにこれまでに確認されているリサンキズマブの安全性プロファイルとおおむね一致しており1-7、新たな安全性のリスクは認められませんでした1-7。重篤な有害事象(SAE)が発現した患者さんの割合は、リサンキズマブ180 mg群で12.3%、360 mg群で13.4%、寛解導入治療のみの対照群では12.5%でした1。リサンキズマブ群で最も多く認められた有害事象(AE)は、クローン病の増悪、上咽頭炎および関節痛でした1。重篤な感染症の発現率は、リサンキズマブ180 mg群で2.8%、360 mg群で4.5%、寛解導入治療のみの対照群では3.8%でした1。治験薬の投与中止に至ったAEの発現率は、リサンキズマブ180 mg群で1.7%、360 mg群で3.4%、寛解導入治療のみの対照群では3.3%でした1。データベースロックの時点では、主要有害心血管イベント(MACE)と判定された事象が2件報告されていました1。1件は寛解導入治療のみの対照群で発現し、もう1件はリサンキズマブ360 mg群で発現しました1。いずれの事象も治験責任医師によって治験薬と関連なしと判定されており、2例とも既存のリスク因子が認められる患者さんでした1。両患者さんとも試験を継続しました1。アナフィラキシー反応の事象や死亡は報告されませんでした1。
以上のトップライン結果は、FORTIFY第III相試験の52週間の維持療法期間で得られたものです。本試験は、寛解導入療法試験であるADVANCE試験またはMOTIVATE試験でリサンキズマブによる寛解導入治療が奏効した中等症から重症のクローン病患者さんを対象に、リサンキズマブによる寛解導入治療のみと比較して、維持療法としてのリサンキズマブの有効性および安全性を評価するために設計されました1。ADVANCE試験およびMOTIVATE試験のトップライン結果は、2021年1月に発表しています。FORTIFY試験の詳細な結果は、今後、学会や査読誌で公表する予定です。クローン病に対するリサンキズマブの使用は承認されておらず、その安全性および有効性も規制当局による評価はされていません。
リサンキズマブは、ベーリンガーインゲルハイムとアッヴィの業務提携の一環で、アッヴィが世界的に開発と販売を主導しています。
クローン病について
クローン病は、胃腸(または消化器)管に炎症が起きることにより、持続的な下痢や、腹痛、直腸出血をきたす慢性、全身性の疾患です11-13。進行性の疾患であり、時間経過とともに悪化します12,13。さらにクローン病の徴候・症状は予測できないため、患者さんにとって身体面だけでなく精神面、経済面にも大きな負担となることもあります14。
FORTIFY試験について1,8
FORTIFY試験は、中等症から重症のクローン病成人患者さんを対象に、リサンキズマブの有効性および安全性を評価するために設計された第III相、多施設共同、無作為化、二重盲検、比較対照、52週間維持療法および非盲検延長試験です。本試験では、無作為化投与中止デザインを採用し、リサンキズマブIVによる寛解導入治療を受け、リサンキズマブが奏効した患者さんを再度、リサンキズマブ180 mg皮下投与群、リサンキズマブ360 mg皮下投与群、リサンキズマブ投与中止群(寛解導入治療のみの対照群)に無作為に割り付けました。リサンキズマブ投与中止群(寛解導入治療のみの対照群)の患者さんは、試験終了時までリサンキズマブを休薬しました。この第III相試験の目的は、ADVANCE試験およびMOTIVATE試験でリサンキズマブIVによる寛解導入治療が奏効した中等症から重症のクローン病患者さんを対象に、リサンキズマブ投与中止(対照群)と比較して、維持療法としてのリサンキズマブ180 mgと360 mgの有効性および安全性を評価することです。
本試験では、各地域の規制要件により、米国内と米国外の解析計画にそれぞれ異なる主要評価項目および副次評価項目を採用しました。主要評価項目は、52週時の内視鏡的改善および臨床的寛解としました。臨床的寛解は、米国内の解析計画ではCDAIを用いて、CDAIスコア150未満を寛解と定義し、米国外の解析計画ではSF/APを用いて、1日の排便回数と腹痛スコアにより評価しました。
内視鏡的改善は、中央審査委員の判定によるSES-CDがベースラインに比べ50%超(病変が回腸に限局しており、ベースラインのSES-CDが4の患者さんではベースラインに比べ50%以上)減少した場合と定義しました。内視鏡的寛解は、中央審査委員の判定によるSES-CDが4以下かつベースラインに比べ2点以上減少しており、個々のサブスコアに1を超えるものがない場合と定義しました。完全寛解とは、同じ患者さんを対象とし、臨床的寛解(CDAI)かつ内視鏡的寛解によって定義される評価項目です。
詳細は、www.clinicaltrials.gov(NCT03105102)をご覧ください。
リサンキズマブについて
リサンキズマブは、インターロイキン-23(IL-23)のp19サブユニットに結合することによりIL-23を選択的にブロックするIL-23阻害薬です15,16。炎症プロセスに関与するサイトカインであるIL-23は、クローン病を含む多くの慢性免疫関連疾患に関連すると考えられています15。2019年4月、リサンキズマブは全身療法または光線療法の候補となる、中等症から重症の成人尋常性乾癬の治療薬として、米国食品医薬品局(FDA)より承認されました。リサンキズマブの用量は150 mgで、0週および4週時の投与後、12週ごとにプレフィルドペンまたはプレフィルドシリンジで投与します。また、リサンキズマブは、2019年4月にEUでも乾癬の治療薬として承認されました。関節症性乾癬(乾癬性関節炎)、クローン病、潰瘍性大腸炎を対象とするリサンキズマブの第III相試験が進行中です8-10。クローン病に対するリサンキズマブの使用は承認されておらず、その安全性および有効性も規制当局による評価はされていません。
米国におけるリサンキズマブについて16
リサンキズマブは、全身療法または光線療法が対象となる中等症から重症の尋常性乾癬の成人患者さんの治療を適応としています。
重要な安全性情報16
感染症
本剤は感染症のリスクを増大させる可能性がある。臨床的に重大な活動性の感染症を有する患者に対しては、回復するか、十分な治療が行われるまで、本剤の投与を開始しないこと。
慢性感染症を発症している患者または回帰感染の既往歴がある患者では、本剤の処方に先立って、リスクとベネフィットを検討すること。患者に対しては、臨床的に重大な感染症の徴候・症状があらわれた場合には、医師の診察を受けるよう指導すること。臨床的に重大な感染症があらわれた場合または標準治療で効果が得られない場合には、患者の状態を十分に観察し、回復するまで本剤の投与を中止すること。
本剤投与前の結核検査
本剤の投与開始に先立って、結核感染の有無を確認し、潜在性または活動性結核があり、十分な治療経過を確認できない患者については、治療を考慮すること。本剤投与中および投与後は、活動性結核の徴候および症状の有無を観察すること。活動性結核を有する患者に本剤を投与しないこと。
予防接種
本剤の投与開始に先立って、最新の予防接種ガイドラインに基づき、年齢に応じたすべての適切な予防接種の実施を検討すること。本剤を投与されている患者においては生ワクチンの使用を避けること。
副作用
本剤投与に伴って高頻度(1%以上)に報告された副作用は、上気道感染、頭痛、倦怠感、注射部位反応、白癬感染などであった。
上記は、すべての安全性情報を完全に要約したものではありません。
処方薬の副作用をFDAに報告することが奨励されています。http://www.fda.gov/medwatchをご覧いただくか、1-800-FDA-1088にお電話ください。
薬剤の支払いが難しい場合は、アッヴィがお手伝いできるかもしれません。詳細については、AbbVie.com/myAbbVieAssist をご参照ください。
こちらから、詳細な処方情報および服薬ガイドについてご参照ください。
世界各国で処方情報は異なります。完全な情報は各国の製品表示をご参照ください。
消化器領域におけるアッヴィについて
潰瘍性大腸炎やクローン病といった炎症性腸疾患(IBD)の領域を大きく発展させるため、アッヴィは強固な臨床試験プログラムを実施し、最先端の研究に取り組んでいます。革新と学習、そして適応を通して、IBDによる患者さんの負担をなくし、患者さんの生活を長期にわたって改善していくことを目指しています。消化管領域におけるアッヴィについて、詳細はこちらをご覧ください。
アッヴィについて
アッヴィのミッションは現在の深刻な健康課題を解決する革新的な医薬品の創製と提供、そして未来に向けて医療上の困難な課題に挑むことです。患者さん一人ひとりの人生を豊かなものにするため次の主要領域に取り組んでいます。免疫疾患、がん、神経疾患、アイケア、ウイルス、ウイメンズヘルス、消化器疾患、さらにアラガンエステティクスポートフォリオの製品・サービスです。アッヴィの詳細については、www.abbvie.com をご覧ください。Twitterアカウント@abbvie、Facebook、LinkedInやInstagramでも情報を公開しています。
