米マサチューセッツ州ダンバース--(BUSINESS WIRE)--(ビジネスワイヤ) -- アビオメッド(Nasdaq: ABMD)は、米国食品医薬品局(FDA)がImpella心臓ポンプの市販前承認(PMA)に関連する最後の市販後臨床試験報告書を受領し、終了したことを発表しました。今回のFDAの決定は、心原性ショック、高リスクPCI、開心術後心原性ショック、心筋炎や心筋症に伴う心原性ショック、右心不全に対するImpellaの安全性と有効性がFDAによってさらに実証されたことを意味します。
FDAは通常、FDA最高レベルの規制認可である市販前承認(PMA)を取得した医療機器に対して、市販後臨床試験を要求します。FDAの市販後臨床試験では、市販前承認(PMA)を取得するためにFDAに提出された臨床試験データが、リアルワールドのより広範な患者集団に適用されることを確認するために、精度の高い前向きデータが使用されます。
アビオメッドは、Impella初の市販前承認(PMA)を取得して以降7年間で、合計5件の市販後臨床試験を完了しました。この大規模な多施設共同研究は、46施設で実施され、合計1,833人の患者さんが組み込まれました。
アビオメッドの最高医学責任者(CMO)であるチャック・サイモントン医師は次のように述べています。「この重要なマイルストーンの達成は、さまざまな臨床上の適応におけるImpellaの安全性と有効性を確認するものです。これらの研究を主導したすべての研究医の皆様、研究に参加してくださった患者さんに心より感謝申し上げます。」
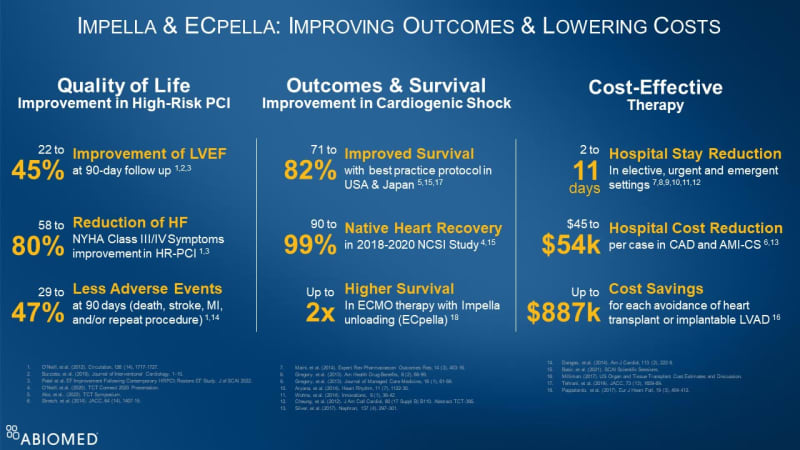
米国、ヨーロッパ、日本でそれぞれ収集・分析されたImpellaのデータは、Impellaが患者さんの予後を改善し、医療費を削減することが示されています。(図1参照)。これらのデータには以下の点が含まれています。
- Impella補助下のProtected PCIは患者さんのQOLを改善させる\- 90日後のフォローアップでは左室駆出率が22%から45%改善、NYHA 分類におけるClass 3および4の症状が58%から80%減少し、90日後の有害事象が29%から47%減少した。
- Impella治療によって心原性ショック患者の予後を改善 \- ベストプラクティスのプロトコルに沿った治療により生存率は71%から82%に改善、2018年から2020年に実施されたNational Cardiogenic Shock Initiative Studyでは自己心回復率が90%から99%に改善、ECMOとImpellaの併用によるアンローディング(ECpellaとして知られています)によって最大で2倍の生存率となることが示された。
- Impellaは費用対効果の高い治療法である \- 待機的、または緊急手術において入院期間を2~11日短縮し、冠動脈疾患および急性心筋梗塞に伴う心原性ショックにおいて1例あたりの病院費用をUS $ 45,000~54,000削減し、心臓移植または植込み型LVADを回避するごとに最大US $ 887,000のコスト削減が可能である。
Impellaは、FDAの歴史の中で最も研究された心臓ポンプであり、2006年から現在に至るまで様々な試研究が行われています。現時点で約20万人のImpella患者に関するリアルワールドデータが存在し(図2、3参照)、Impellaに関する1,200以上の査読付き論文が発表されています。また、Impellaは13の学会の治療ガイドラインにも掲載されています。
FDA、PMDA(日本の医薬品医療機器総合機構)および欧州Medical Device Agencyで実施されたすべてのImpella試験から得られた臨床データとベストプラクティスは、前向きデータとリアルワールドデータと組み合わせて、PROTECT IVおよびRECOVER IV無作為化対照試験のデザインに反映されています。これらのオンラベル試験は、高リスクPCIおよび心筋梗塞に伴う心原性ショックに対するImpellaのガイドライン推奨度 Class Iを達成するためのエビデンスレベルに合ったデザインがされています。
______________________________
1. O’Neill, et al. (2012). Circulation, 126 (14), 1717-1727.
2. Burzotta, et al. (2019). Journal of Interventional Cardiology, 1–10.
3. Patel et al. EF Improvement Following Contemporary HRPCI: Restore EF Study. J of SCAI 2022.
4. O’Neill, et al. (2020). TCT Connect 2020 Presentation.
5. Ako, et al.. (2022). TCT Symposium.
6. Stretch, et al. (2014). JACC, 64 (14), 1407-15.
7. Maini, et al. (2014). Expert Rev Pharmacoecon Outcomes Res, 14 (3), 403-16.
8. Gregory, et al. (2013). Am Health Drug Benefits, 6 (2), 88-99.
9. Gregory, et al. (2013). Journal of Managed Care Medicine, 16 (1), 61-69.
10. Aryana, et al. (2014). Heart Rhythm, 11 (7), 1122-30.
11. Wohns, et al. (2014). Innovations, 9 (1), 38-42.
12. Cheung, et al. (2012). J Am Coll Cardiol, 60 (17 Suppl B) B110. Abstract TCT-385.
13. Silver, et al. (2017). Nephron, 137 (4), 297–301.
14. Dangas, et al. (2014). Am J Cardiol, 113 (2), 222-8.
15. Basir, et al. (2021). SCAI Scientific Sessions.
16. Milliman. (2017). US Organ and Tissue Transplant Cost Estimates and Discussion.
17. Tehrani, et al. (2019). JACC, 73 (13), 1659-69.
18. Pappalardo, et al. (2017). Eur J Heart Fail, 19 (3), 404-412.
IMPELLA心臓ポンプについて
Impella CP SmartAssistは、閉塞した冠動脈を再開通させるためにステント留置術やバルーン血管形成術などの経皮的冠動脈インターベンション(PCI)を受ける特定の高度心不全患者の治療として米国FDAに承認されています。
Impella CP SmartAssistおよびImpella 5.5 SmartAssistは、心原性ショック状態にある心臓発作や心筋症患者の治療として米国FDAから承認されており、心臓の自然な回復を可能にする独自の機能を有しているため、患者さんが自分の心機能を回復させ帰宅することができます。
Impella RP SmartAssistは、左心室補助装置の植込み、心筋梗塞、心臓移植、開心術後の右心不全または心不全の治療に使用することが米国FDAにより承認されています。
将来見通しに関する記述
将来見通しに関する記述はいずれも、アビオメッドが米国証券取引委員会に提出した定期報告書で記載されたものなど、リスクと不確実性の影響を受けます。実際の結果は予想された結果とは大きく異なる可能性があります。
本プレスリリースは、米国アビオメッド・インクが現地時間2022年10月21日に発表した英文プレスリリースを日本語訳したものです。正式な言語は英語であり、日本に適応しない内容が含まれます。解釈は英語が優先されます。
本記者発表文の公式バージョンはオリジナル言語版です。翻訳言語版は、読者の便宜を図る目的で提供されたものであり、法的効力を持ちません。翻訳言語版を資料としてご利用になる際には、法的効力を有する唯一のバージョンであるオリジナル言語版と照らし合わせて頂くようお願い致します。
Contacts
For further information:
Media:
Jenny Leary
Associate Director, U.S. Communications
+1 (978) 882-8491
jleary@abiomed.com
Investors:
Todd Trapp
Executive Vice President and Chief Financial Officer
+1 (978) 646-1680
ttrapp@abiomed.com

