薬剤耐性細菌感染症治療への応用
2022年11月22日
国立大学法人東海国立大学機構 岐阜大学
細菌の天敵ウイルス「バクテリオファージ」を試験管内で 改変する方法および生物学的に封じ込める方法を開発 薬剤耐性細菌感染症治療への応用
【本研究のポイント】
・様々なバクテリオファージのゲノムを試験管内で自由に改変・構築して起動する技術を開発しました。
・化学合成されたDNAからゲノムを構築して、親としてファージを持たない人工ファージを創出しました。
・ファージの生物学的封じ込め1)法を開発しました。
・致死性敗血症マウスに対して、生物学的封じ込めファージは明らかな治療効果を示しました。
【研究概要】
抗菌薬の効かない細菌感染症の蔓延に伴い、細菌に感染する天敵ウイルスである「バクテリオファージ」(ファージ)を使った治療法「ファージセラピー」が注目を集めています。自然環境などに存在する天然(野生型)ファージに加え、近年では遺伝子組換えなどを施した改変型ファージを使うアプローチも報告されています。機能性を高めた改変型ファージは、より効果的なファージセラピーを可能にするものと期待されています。しかし、従来の手法によって改変できるファージは極めて限定的でした。また、改変型ファージを封じ込める(環境中に拡散させない)ための技術開発についての報告はありませんでした。
岐阜大学医学系研究科ファージバイオロジクス研究講座の満仲翔一研究員(筆頭著者)、安藤弘樹 特任准教授(責任著者)らのグループは、ファージゲノムを試験管内で改変・構築して起動できるファージ合成改変技術を開発しました。これを使って実際に多くのファージを起動させ、また、データベース上の配列データからDNAを化学合成し、試験管内で構築し、人工ファージを起動させることにも成功しました。これらの結果は、本技術の汎用性が高いことを示しています。さらに、一回しか感染・殺菌しない生物学的封じ込めファージの作製方法を開発しました。本技術を改変型ファージに応用することで、より効果的でより安全な改変型ファージセラピーの実現が期待されます。
本研究成果は、日本時間2022年11月21日にProceedings of the National Academy of Sciences(PNAS)誌のオンライン版で発表されました。
【研究背景】
バクテリオファージ(ファージ)は細菌に感染するウイルスで、宿主細菌への吸着、細菌内での増殖、溶菌を介した子ファージの外環境への放出、新たな宿主細菌への感染を繰り返します。この生活環を利用した細菌感染症治療法は「ファージセラピー」と呼ばれ、抗菌薬が効きにくい、もしくは全く効かない多剤耐性細菌感染症に対する新たな治療法として注目されています。しかしながら、ファージ(セラピー)にもいくつかの弱点があります。例えば、宿主域2)の狭さです。同じ細菌種でも株の違いによって感染できないことが多々あります。また、宿主域の狭さはファージ耐性菌の出現のしやすさにも繋がります。したがって、ファージセラピーには異なる宿主域を持つ複数のファージを混合したファージカクテルを用いるのが一般的です。カクテルを調製する際もファージの種類によってはお互いの効果を打ち消し合ってしまうことがあり、ファージの相性や安定性を考慮する必要があります。
これらの弱点については、ファージを改変することで克服できる可能性があります。例えば、一種類(単一)のファージを用意して、これを改変することで異なる宿主域を与えられるという報告があります。これらの単一でありながら宿主域だけが異なるファージをカクテルとして用いることで、効果的な殺菌とファージ耐性菌の抑制が可能であることが報告されています。また、抗菌遺伝子などをファージに搭載させることによって、殺菌効果を向上させられることも分かっています。改変型ファージを使えばファージセラピーのさらなる治療効果の向上が期待できますが、これを実現するには二つの大きなハードルを越える必要があります。一つは、ファージを改変することが極めて難しいことです。改変できるのは一部のモデルファージもしくは特殊な改変系が確立されているごく少数のファージに限定されていました。近年ではファージゲノムを構築し、宿主細菌に導入することで改変型ファージを創出する手法がいくつか報告されましたが、やはり対象は限定され、汎用性が実証されていませんでした。もう一つは、改変型ファージが遺伝子組換え生物3)に該当するため、環境中への拡散を防ぐ必要があることです。私たちの知る限りでは、今までにそのような技術開発に関する報告はありませんでした。
私たちは、効率的かつ迅速な汎用性ファージ合成改変技術を開発し、またこれを応用して改変型ファージを生物学的に封じ込めることで、二つのハードルを乗り越え、より効果的でより安全な改変型ファージセラピーを社会実装できると考えました。
【研究成果】
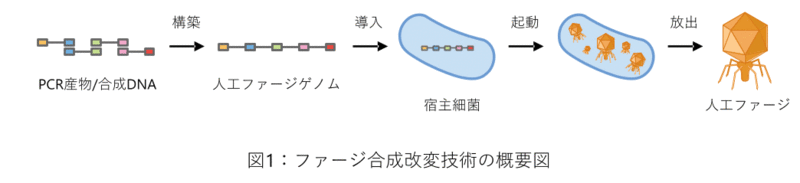
PCR産物からファージゲノムを試験管内で構築し、エレクトロポレーション法4)によって宿主細菌に導入することで、ファージを起動しました(図1)。様々なグラム陰性細菌に感染する複数のファージ、特殊な膜構造を有する抗酸菌に感染する複数のファージ及びこれらの改変ファージの起動に成功しました。この結果は、私たちのプラットフォーム技術の汎用性の高さを示すものです。
本手法を用いて、配列データを基に化学合成されたDNAから抗酸菌ファージを創出することに成功しました。このファージのゲノムサイズは52,797 bpで、私たちが知る限りではこれまでに化学合成されたDNAから創出されたウイルスとしては最長サイズになります。また、創出したファージのゲノムは1塩基の違いもなくデザイン通りでした。この結果は、コンピューターでデザインした完全なテーラーメイドファージの創出が可能であることを示しています。
大腸菌に感染するファージのゲノムを試験管内で構築し、これを大腸菌の粗抽出液から調製された無細胞転写翻訳系に加えることで機能的なファージを創出することに成功しました。この結果は、ファージゲノムの構築から起動までの全工程を、生物を介さずに試験管内だけで行えることを示しています。本研究の一部はトヨタ紡織株式会社との共同研究として実施されました。
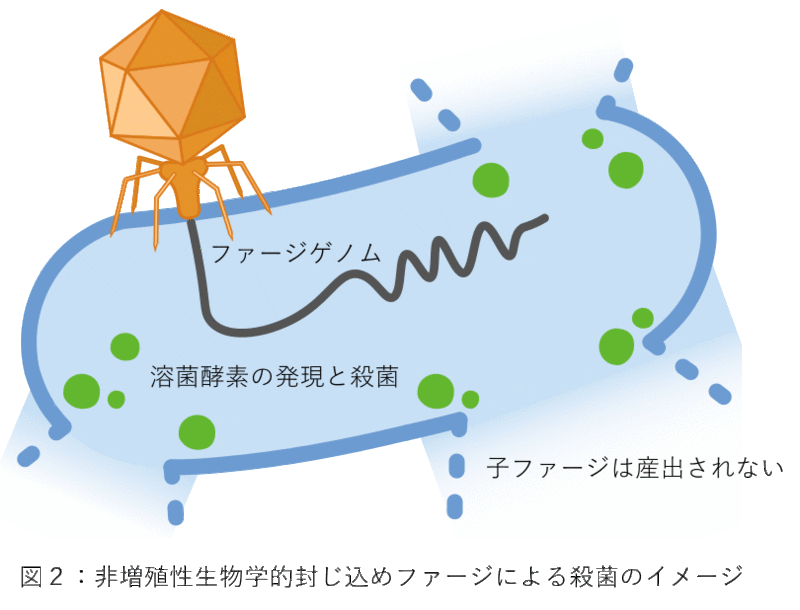
ファージ合成改変技術を応用して、二つの生物学的封じ込め法を開発しました。一つはファージゲノムの代わりにプラスミドDNA 5)をファージの頭部に詰め込むというものです。このファージは、標的細菌に感染すると宿主細菌にプラスミドDNAを注入し、機能を発現します。ファージゲノムを持たないためファージが増殖することはありません。もう一つは、ファージゲノムからビリオン遺伝子6)を除くというものです。このファージは見た目も感染性も殺菌性ももとのファージと変わりませんが、子ファージを作ることができません(図2)。一回限りの感染と殺菌を可能にする非増殖性の生物学的封じ込めファージと言えます。非増殖性ファージは欠失したビリオン遺伝子を発現する宿主細菌を介して増殖させることができるのも特徴です。
致死性の敗血症7)に罹ったマウスに対して非増殖性ファージを用いたファージセラピーを実施した結果、明らかな治療効果を示しました。また、治療したマウス体内から増殖可能なファージは見つかりませんでした。この結果は、非増殖性ファージがファージセラピーに利用可能であり、100%の封じ込めに成功したことを示すものです。
【今後の展開】
私たちのファージ合成改変技術は、様々なファージ種に適用できるものです。より有用なファージを創り出し、必要に応じて生物学的封じ込めを施すことで、より効果的でより安全な改変型ファージセラピーが実現できると考えています。天然ファージを用いるファージセラピーや抗菌薬との併用療法も視野に入れ、ファージセラピーの一日も早い実現に向かって邁進します。
【論文情報】
雑誌名:Proceedings of the National Academy of Sciences (PNAS)
論文タイトル:Synthetic engineering and biological containment of bacteriophages
著者:Shoichi Mitsunaka, Kohei Yamazaki, Ajeng K. Pramono, Megumi Ikeuchi, Tomoe Kitao, Naoya Ohara, Tomoko Kubori, Hiroki Nagai, Hiroki Ando
DOI:10.1073/pnas.2206739119
【用語解説】
1) 生物学的封じ込め : 遺伝子組換え生物が環境中に放出されても自然界で生存できないような遺伝的性質をあらかじめ与えておく方策。
2) 宿主域 : 感染できる宿主の種類の幅。“宿主域が狭い”は感染できる宿主の種類が少ないという意味。
3) 遺伝子組換え生物 : 遺伝子工学の技術を用いて遺伝子を操作された生物。
4)エレクトロポレーション法 : 短パルスの電流を利用して、細菌や細胞にDNAやRNAなどを導入する方法。
5)プラスミドDNA : 細菌や酵母の細胞内に存在し、染色体DNAとは独立して複製される小さな環状のDNA分子。
6) ビリオン遺伝子 : ファージゲノム上に存在しており、ファージを形成するためのタンパク質をコードする遺伝子。
7)敗血症 : 細菌、ウイルス、真菌などの感染症に対する生体反応が制御不能に陥ることで、生命を脅かす臓器機能障害が生じる症状。感染症がきっかけで起きる、二次的な症状。
【研究支援】
本研究は科学研究費助成事業(19K16636、15K21770)及びアステラス製薬株式会社の支援を受けて行われました。
【研究者プロフィール】
筆頭著者・満仲 翔一(みつなか しょういち)
岐阜大学医学系研究科ファージバイオロジクス研究講座・研究員
2017年に立教大学で学位取得(博士(理学)、腸管出血性大腸菌のプロファージ内に存在するsRNAに関する研究)。学位取得後、岐阜大学医学系研究科病原体制御学分野に着任。2020年より現職。専門は分子生物学、合成生物学。
責任著者・安藤 弘樹(あんどう ひろき)
岐阜大学医学系研究科ファージバイオロジクス研究講座・特任准教授
アステラス製薬株式会社・創薬アクセレレーター・Venture Unit Engineered Phage Therapy・Principal Investigator
2007年に大阪大学で学位取得(博士(医学)、腸管出血性大腸菌のIII型分泌装置に関する研究)。学位取得後、国立国際医療研究センター、マサチューセッツ工科大学を経て、2017年に岐阜大学医学系研究科病原体制御学分野に着任。2020年より現職。専門は細菌学、合成生物学。
